Hombres obesos diabéticos o no diabéticos pueden tener bajos niveles de testosterona

La testosterona es la principal hormona sexual en los varones. Es importante no sólo para el funcionamiento sexual normal, sino también para mantener la fuerza ósea y muscular, la energía mental y física y el bienestar general. El bajo nivel de testosterona va asociado a
- disminución de la libido,
- disfunción eréctil,
- aumento de masa adiposa,
- disminución del músculo, la masa ósea y la energía,
- depresión y anemia.
La diabetes tipo 2 podría ser una de las causas más frecuentes de hipogonadismo, que es la falta de actividad de los testículos, que afecta de manera adversa a la producción de testosterona. Recordemos que al menos un 25% de los diabéticos padecen esta enfermedad sin saberlo.
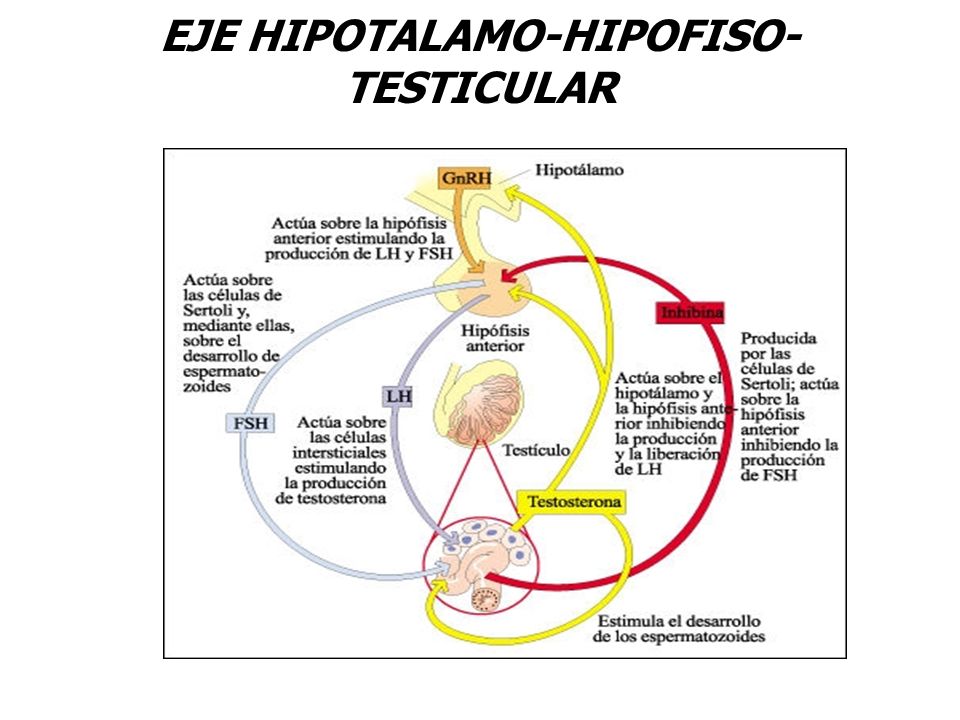
La producción de testosterona en las células de Leydig de los testículos viene estimulada por la hormona luteinizante, que segrega la glándula pituitaria, ubicada en la base del cerebro. Esa glándula también produce hormonas folículoestimulante y que estimulan la producción de esperma.
En la mujer esas hormonas son muy importantes la FSH u hormona foliculo estimulante es sintetizada y secretada por células gonadotropas de la parte anterior de la glándula pituitaria. Regula el desarrollo, el crecimiento, la maduración puberal en las niñas, y los procesos reproductivos del cuerpo. Produce la maduración de los ovocitos. En conjunto la FSH y la hormona luteinizante LH actúan en la reproducción. La FSH estimula la producción de ovocitos y de estradiol durante la primera mitad del ciclo menstrual.
La hormona luteinizante y la hormona folículoestimulante son conocidas como gonadotropinas y son liberadas en respuesta al fator u hormona liberadora de gonadotropina se produce en el hipotálamo.
La testosterona afecta tanto al hipotálamo como a la glándula pituitaria, haciendo que se reduzca la secreción de hormona. Esto coincide con el “hipogonadismo secundario” o “hipogonadotrófico” y se ha demostrado que un tercio de los hombres de edad media con diabetes tipo 2 tiene un bajo nivel de testosterona biológicamente activa.
Varios estudios durante las últimas dos décadas han demostrado que las personas con diabetes tipo 2 tienen un bajo nivel de testosterona. Sin embargo, estos estudios se basaron en los niveles totales de testosterona, que podrían no reflejar con exactitud los niveles de “testosterona libre” biológicamente activa.
La testosterona en un varón normal va predominantemente unida a la globulina transportadora de hormonas sexuales (44%) y la albúmina (55%); tan sólo alrededor del 2% circula como testosterona libre y solamente esta testosterona libre puede entrar en los tejidos del organismo y ejercer sus efectos. La testosterona que va unida a la albúmina puede liberarse en los vasos pequeños, y ejercer un acción biológica, sin embargo, la que permanece unida a la globulina transportadora de hormonas sexuales no tiene ninguna acción.
Un primer estudio del año 2004 documentó una alta prevalencia de hipogonadismo en la diabetes tipo 2 basándose en la testosterona libre. Se demostró que un tercio de los varones con diabetes tipo 2 (de edades comprendidas entre los 31 y los 75 años) tiene un bajo nivel de testosterona libre.
Esto va asociado a un nivel anormal de LH y FSH, lo cual genera hipogonadismo hipogonadotrófico. Los niveles de testosterona total y libre decrecieron, tal y como se esperaba, con la edad y con el aumento del índice de masa corporal. A mayor obesidad menor cantidad de testosterona, pero se encontró que el 25% de los varones delgados también tenía hipogonadismo hipogonadotrófico cuando padecían de diabetes tipo 2 desde el inicio de su problema ya que la duración de la diabetes y los niveles de hemoglobina glicada no afectaban a los niveles de testosterona.
También se ha estudiado la prevalencia de hipogonadismo hipogonadotrófico en varones jóvenes con diabetes tipo 2 y se detectó que el 58% de los hombres diabéticos de entre 18 y 35 años tenía hipogonadismo hipogonadotrófico. Todos estos varones hipogonadales tenían índices de masa corporal superior a 30 Kg/m2. Esta circunstancia se asocia con un aumento de la grasa corporal y una disminución de la masa magra muscular que contribuyen al tipo de sobrepeso con distribución centrípeta o ginecoide en esos pacientes.
Otros efectos El problema del hipogonadismo hipogonadotrófico no se limita tan sólo a la función sexual y reproductiva, sino también es posible que esté relacionado con las enfermedades cardiovasculares y la aterosclerosis, depósitos grasos que recubren las paredes interiores de las arterias, precursores del infarto de miocardio.
También la inflamación, el proceso por el cual el organismo responde ante las lesiones y/o las infecciones, tiene un papel fundamental en el desarrollo de aterosclerosis. Los altos niveles de proteína C-reactiva (PCR), un marcador de la inflamación, se han asociado a un aumento del riesgo de enfermedad coronaria arterial y en varones con diabetes tipo 2 e hipogonadismo hipogonadotrófico, se encontraron altos niveles de PCR asociada frecuentemente con anemia leve (11 a 14 de hemoglobina), una baja densidad ósea (costillas y brazos), aumento de la masa adiposa total y subcutánea y una disminución de la masa musculoesquelética.
Los mecanismos que se encuentran tras el hipogonadismo hipogonadotrófico en varones con diabetes tipo 2 no están claros. Se ha sugerido que un aumento excesivo de la masa adiposa podría generar un aumento de la actividad de la enzima aromatasa, que causa una mayor conversión de la testosterona en estrógeno (la principal hormona sexual femenina) y un aumento de los niveles de estrógeno llevaría a la supresión de la hormona liberadora de gonadotropina y a una alteración de la secreción por parte de la glándula pituitaria lo que explicaría la reducción tanto de la secreción de testosterona como de la producción de esperma maduro en hombres con diabetes y sobrepeso aunque recordemos que los varones no obesos con diabetes tipo 2 podrían también sufrir hipogonadismo hipogonadotrófico.
Por lo tanto, el estado del hipogonadismo hipogonadotrófico no depende enteramente de la obesidad. Basándonos en estudios con animales y en experimentos con cultivos celulares, cada vez resulta más evidente que la acción de la insulina y la capacidad de respuesta ante la insulina en el cerebro son necesarias para el funcionamiento adecuado del eje hipotálamo-hipófisis (hipotálamo, glándula pituitaria, testículos). Por lo que la resistencia a la insulina o síndrome metabólico que podría ser mucho más frecuente de lo que se piensa en hombres jóvenes, podría contribuir al desarrollo de hipogonadismo hipogonadotrófico que sería el equivalente masculino del síndrome de ovarios poliquísticos (PCOS) de las mujeres.
La insensibilidad a la insulina también va asociada a un aumento de la concentración de proteínas inflamatorias en la sangre que podrían suprimir directamente la producción de hormona liberadora de gonadotropina desde el hipotálamo.
En el caso de varones con síntomas hipogonadales u obesidad tipo ginceoide con o sin diabetes, se recomienda estudiar la resistencia a la insulina y los niveles de esa hormona en ayunas y en estado post-prandial.
La opción recomendada de tratamiento es la terapia de reemplazo de testosterona, con el fin de mejorar la función sexual, mantener las características sexuales secundarias, aumentar la sensación de bienestar y la densidad mineral ósea, así como para aumentar la masa muscular y reducir la masa adiposa.
La testosterona puede inducir un aumento de antígeno específico de la próstata y del volumen de hematíes por lo que está contraindicada en pacientes con hiperplasia prostática, cáncer de próstata o de mama.