Obesidad, adipogénesis y resistencia a la insulina
Frecuentemente la resistencia a la insulina precede al desarrollo de diabetes tipo 2, y además es una constante en el síndrome metabólico que hoy en día, según la OMS, afecta a más del 15% de la población, sobre todo femenina. Aunque la causa de este proceso no está clara, parece intervenir los cambios en el estilo de vida con un escaso ejercicio físico y accesibilidad constante a alimentos, especialmente en los países occidentales. Esto se junta a factores genéticos, son los que han disparado la escalada de las enfermedades relacionadas con el metabolismo que han sido estudiadas en el estudio CARMEN (Conjunto de Acciones para la Reducción Multifactorial de las Enfermedades no Transmisibles) de la Organización Panamericana de la Salud.
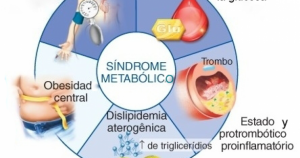
| El síndrome metabólico (SM) es un conjunto de anormalidades metabólicas consideradas como un factor de riesgo para desarrollar enfermedad cardiovascular, obesidad y diabetes. Los componentes del SM se han definido según diferentes guías y consensos. Las definiciones propuestas por el National Cholesterol Education Program Adult Treatment Panel III (ATP III) y la International Diabetes Federation (IDF) son las más utilizadas en las diferentes publicaciones; sin embargo, se han realizado actualizaciones para diferentes poblaciones según la etnia y ubicación geográfica, como es el caso de la Asociación Latinoamericana de Diabetes (ALAD), que define un perímetro abdominal determinado para la región. En el año 2009, la publicación Harmonizing the Metabolic Syndrome sugirió un consenso para el diagnóstico de SM tratando de unificar los criterios de las diferentes organizaciones. Respecto a la forma de aparición del SM, la resistencia a insulina ha sido considerada como base del desarrollo del conjunto y la obesidad abdominal o central como responsable del desarrollo de esa resistencia. Las adipoquinas producidas por el tejido adiposo abdominal actúan directa o indirectamente en el desarrollo de los componentes del síndrome. Es importante mencionar que el síndrome ha sido considerado un equivalente diagnóstico de pre-diabetes, por ser predictor de diabetes y que el incremento en la prevalencia del SM a nivel mundial le ha otorgado una gran importancia en la prevención y control de riesgo de la enfermedad cardiovascular y la diabetes. |
La obesidad, sobre todo la de acumulación alrededor de la cintura en adolescentes y adultos jóvenes, es un factor de riesgo para desarrollar resistencia a insulina, pero no es el único ya que el síndrome se puede producir en jóvenes relativamente delgados, pero muy poco frecuentemente.
El aumento del tejido adiposo se relaciona con el aumento de la producción de citoquinas pro-inflamatorias, que junto a ácidos grasos saturados, resultan ser los responsables del desarrollo de la resistencia a insulina. También la mayor o menor capacidad del tejido adiposo para almacenar grasa juega un papel importante en el desarrollo del síndrome de Reaven ya que cuando se supera esta capacidad, variable en cada persona, se produce el escape de lípidos que se acumulan en otros tejidos donde podrían interferir con las señales para la liberación y acción periférica de la sobre el GLUT-4 que es el factor de acción relacionado con la insulina sobre todo en el tejido adiposo y muscular, aunque en menor proporción también presente en células hepáticas, en los glóbulos blancos, en las gónadas y en la piel.
En relación con las gónadas tenemos el síndrome de ovario poliquístico (PCOS). Éste es una entidad heterogénea que se caracteriza por hiper-androgenismo y oligomenorrea (predominancia de características de masculinización y falta de menstruación o menstruación irregular). Presenta este síndrome el 75% de las mujeres con trastornos menstruales importantes y un alto porcentaje de los casos de infertilidad por falta de ovulación. En los últimos años se ha demostrado que es la patología subyacente en más de 85% de las mujeres con hirsutismo y en 45% de los abortos que ocurren en la etapa temprana del embarazo.
Este síndrome tiene su sustentación endocrina en aumento de la testosterona libre (hormona masculina), de la testosterona total, de la dehidro-epiandrosterona y de la 17-hidroxiprogesterona, junto con una disminución de la globulina ligadora de hormonas sexuales y un aumento de la relación LH/FSH. (hormona luteininzante sobre hormona folículo estimulante). Todo en relación con un ambiente metabólico dominado por un exceso de insulina que actúa en las gónadas aumentando el ingreso de glucosa, algunos aminoácidos y ácidos grasos. Por otra parte, la insulina actúa directamente en el ovario, estimulando la producción de testosterona en las células de la teca interna de los folículos del ovario, lo que origina el hirsutismo, la oligomenorrea, el acné, la relación talla/cintura aumentada y la anovulación crónica e infertilidad secundaria.
Inicialmente, la resistencia a insulina genera mecanismos compensatorios, de forma que durante un período de tiempo, la secreción aumentada de insulina mantiene la glucemia en rango normal en el período que denominamos pre-diabético, resulta difícil de detectar desde el punto de vista clínico, precisamente por el mantenimiento de los valores de glucemia dentro de la normalidad.
Las mediciones de insulina nos pueden ayudar, pero no siempre ya que el efecto sanguíneo de la insulina es de corta duración y es posible que el examen no detecte los picos de producción y tengamos un valor normal aún en presencia de síndrome metabólico. Por eso la OMS insiste en que el diagnóstico debe hacerse por los signos clínicos.
Esta situación, en la mayor parte de los casos, se deteriora progresivamente al presentarse el fracaso pancreático, cuando las células beta no solo no son capaces de mantener la secreción aumentada de insulina que demanda el metabolismo, sino que empiezan a deteriorarse disminuyendo su número por muerte relacionada con el mismo exceso de insulina y otros factores que no conocemos detalladamente.
Durante los últimos años se ha estudiado la asociación del genoma humano y se han identificado varios loci involucrados en enfermedades como la obesidad y la diabetes. Más de 35 loci susceptibles se han identificado para la diabetes tipo 2 y 32 para la obesidad.
Estos datos genéticos y epidemiológicos aceleran el estudio de los mecanismos que regulan la sensibilidad a la insulina. La insulina no solo regula la glucosa, sino que también tiene un papel importante en el metabolismo de los lípidos y proteínas, cuyo metabolismo a su vez puede verse alterado en estados de resistencia a la insulina. Es evidente que debido a esta complejidad del sistema, los estudios no sólo se han dirigido a la caracterización de vías de señalización de la insulina in vitro y al desarrollo de modelos in vivo para poder establecer cualquier correlación fisiológica, sino también al estudio de otros factores extrínsecos que afectan a las diversas moléculas en la cascada de señalización de la insulina y que podrían estar implicados en el desarrollo de resistencia a insulina.
¿Cuál son los factores de riesgo del síndrome metabólico?
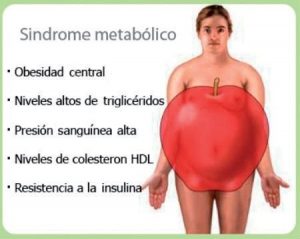
Las personas con síndrome metabólico tienen una conjunción de los siguientes factores de riesgo:
- Obesidad central, es decir, un exceso de grasa en la zona abdominal.
- Presión arterial alta de 130/85 mm.Hg. (milímetros de mercurio) o superior. Una medición normal de presión arterial es 120 mm.Hg. o menos para la presión sistólica (la máxima) y 80 mm.Hg. o menos para la presión diastólica (la mínima).
- Elevación de glucosa en sangre en ayunas nivel igual o superior a 150 mg./dl.
- Niveles elevados de triglicéridos: más de 150 mg./dl. (miligramos por decilitro). Los triglicéridos son un tipo de grasa en la sangre.
- Niveles bajos de colesterol HDL (el colesterol «bueno»), definido como menos de 40 mg./dl. en los hombres y menos de 50 mg./dl. en las mujeres.